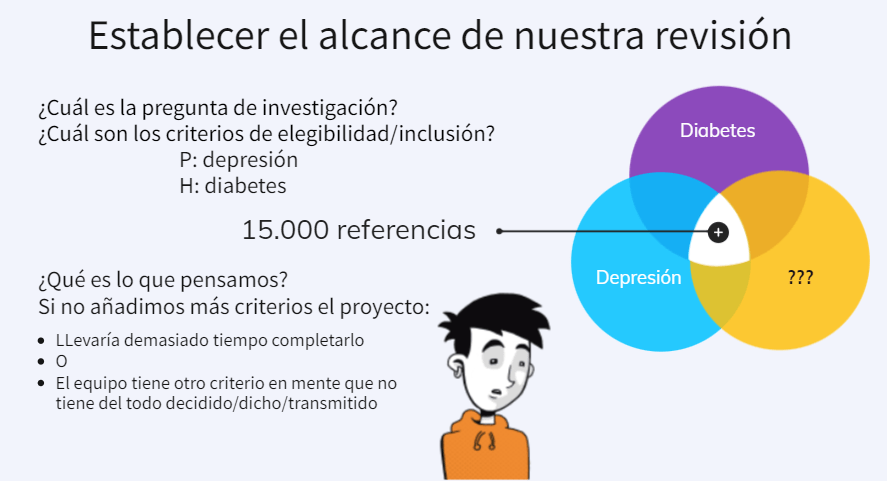
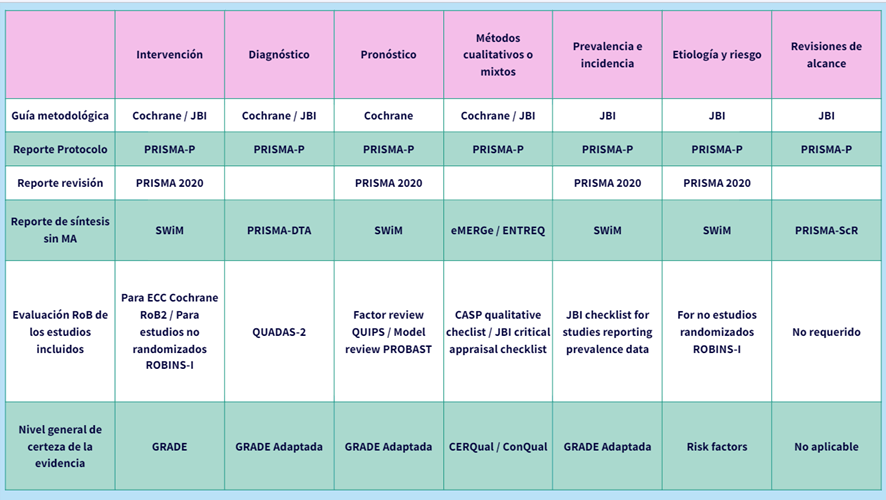
Mañana, 17 de abril de 2024, impartir el Taller de revisiones de alcance («scoping reviews») dentro de las XXV Jornadas de Gestión de la Información» de la SEDIC.

Aquí os dejo una práctica que he confeccionado para la definición de este tipo de revisiones:
Al final del taller, haremos el siguiente juego para evaluar lo aprendido:
BIBLIOGRAFÍA
Munn Z, Pollock D, Khalil H, Alexander L, McInerney P, Godfrey CM, et al. What are scoping reviews? Providing a formal definition of scoping reviews as a type of evidence synthesis. JBI Evid Synth 2022;20 (4):950–952.
Munn Z, Peters MDJ, Stern C, Tufanaru C, McArthur A, Aromataris E. Systematic review or scoping review? Guidance for authors when choosing between a systematic or scoping review approach. BMC Med Res Methodol 2018;18 (1):143.
Peters MDJ, Godfrey C, McInerney P, Khalil H, Larsen P, Marnie C, et al. Best practice guidance and reporting items for the development of scoping review protocols. JBI Evid Synth 2022;20 (4):953–958.
Khalil H, Peters MDJ, Tricco AC, Pollock D, Alexander L, McInerney P, et al. Conducting high quality scoping reviews-challenges and solutions. J Clin Epidemiol 2021;130:156–160.
Peters MDJ, Marnie C, Tricco AC, Pollock D, Munn Z, Alexander L, et al. Updated methodological guidance for the conduct of scoping reviews. JBI Evid Implement 2021;19 (1):3–10.
PRISMA extension for Scoping Reviews (PRISMA-ScR): checklist and explanation. Ann Intern Med 2018;169 (7):467–473.Pollock D, Peters MDJ, Khalil H, McInerney P, Alexander L, Tricco AC, et al. Recommendations for the extraction, analysis, and presentation of results in scoping reviews. JBI Evidence Synthesis [Internet]. 2022 Sep 8 [cited 2022 Sep 9];Publish Ahead of Print. Available from: https://journals.lww.com/jbisrir/Fulltext/9900/Recommendations_for_the_extraction,_analysis,_and.76.aspx